 heliX +
heliX +
Uživatelská příručka
heliX plus Amine Coupling Kit 1
SADA AMINOVÉ SPOJKY 1
Vazba molekul s primárními aminy na řetězec ligandu – proFIRE
čištění
Dynamic Biosensors GmbH & Inc.
HK-NHS-1 v8.1

Klíčové vlastnosti
- Umožňuje navázání biomolekul s primárními aminy (např. NH2-konec, lysiny) na vlákno Ligand v jediné reakční zkumavce.
- Pohodlná standardní chemie (NHS chemie).
- Kompatibilní s adaptérovým čipem heliX®.
- Kompatibilní s čištěním proFIRE® pro čisté konjugáty ligand-DNA (> 5 kDa).
- Vazba více ligandů může být provedena současně.
- Výtěžky > 95 % čistý konjugát ligand-DNA s uživatelsky stanovenou kvalitou konečného produktu.
- Obsahuje reagencie pro pět jednotlivých konjugačních reakcí (každá cca 10-50 regenerací; až do max. 500).
- Kompatibilní s automatickým standardním regeneračním procesem.
Workflow Overview
Pracovní postup konjugace ve 3 krocích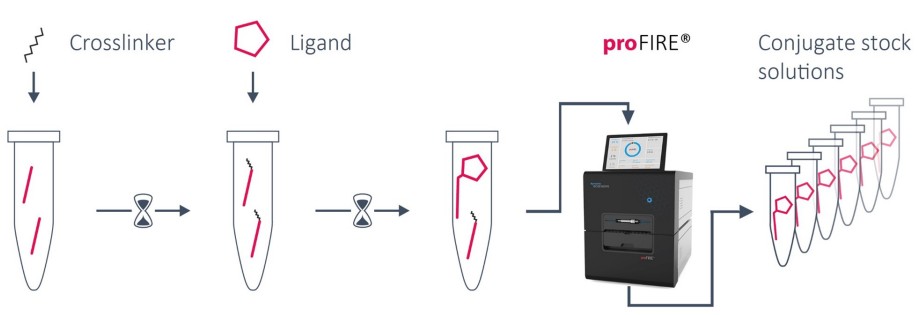
| 1. Modifikace DNA | 2. Konjugace ligandu | 3. Očista | 4. Připraveno k použití |
| Ligandový řetězec je funkcionalizován primárním aminem reaktivním NHS. | Biomolekula (ligand) se přidá k funkcionalizovanému vláknu Ligandu a inkubuje se alespoň 1 hodinu. | Ligandový konjugát je purifikován pomocí systému proFIRE®. Po výměně pufru jsou konjugáty rozděleny na alikvoty a skladovány. | Zásobní roztoky konjugátu jsou připraveny k použití v biosenzoru heliX®. |
Časová osa: Hands on time < 1 h | Inkubace ~ 2 h | Celkem ~ 3 hodiny
Popis produktu
Objednací číslo: HK-NHS-1
Tabulka 1. Informace o obsahu a úložišti
| Materiál | Víčko | Množství | Skladování |
| Ligandový řetězec NHS | Modrý | 5 XNUMX x | -20 °C |
| Vyrovnávací paměť A [1] | Průhledný | 1 x 1.8 ml | -20 °C |
| Buffer C [2] | Průhledný | 5 x 1.8 ml | -20 °C |
| Vyrovnávací paměť PE40 [3] | Průhledný | 5 x 1.5 ml | -20 °C |
| ddH2O | Průhledný | 1.5 ml | -20 °C |
| Zesíťovadlo | Hnědý | 5 XNUMX x | -20 °C |
| Čistící kolona | Červený | 10 XNUMX x | 2-8 °C |
| 2.0 ml reakční zkumavky pro purifikační rotační kolonu | 10 XNUMX x | RT | |
| Odstředivá filtrační jednotka (3 kDa MWCO)[4] | 5 XNUMX x | RT | |
| Centrifugační sběrná zkumavka | 10 XNUMX x | RT |
Centrifugační sběrná zkumavka
Pouze pro výzkumné použití.
Tento produkt má omezenou dobu použitelnosti, viz datum spotřeby na štítku.
DŮLEŽITÉ
Produkty mohou být zasílány při různých teplotách, ale skladování by mělo být v souladu s pokyny uvedenými v tabulce.
Souprava obsahuje reagencie dostatečné pro pět konjugací po přibližně 50-200 µg biomolekuly.
Suspenze pryskyřice v čistící rotační koloně obsahuje 0.02 % azidu sodného.
| Materiál | Komentáře |
| Stolní mikrocentrifuga | Požadovaný rozsah otáček mezi 1,000 13,000 xg až XNUMX XNUMX xg |
| Vír | |
| 1.5 ml reakční zkumavky | |
| UV-Vis spektrofotometr (např. Nanodrop) | Pro stanovení koncentrace konjugátu ligandového vlákna |
Všechny potřebné roztoky a pufry jsou součástí sady.
Důležité poznámky
A. Lyofilizovaný řetězec Ligandu nemusí být vždy nalezen na dně zkumavky; mohl by zůstat na stěně zkumavky nebo v uzávěru zkumavky. Vždy prosím zkontrolujte přítomnost lyofilizovaného vlákna Ligandu, které lze identifikovat podle jeho čirého vzhledu pelet (možná budete muset odstranit štítek zkumavky, abyste jej viděli). Pokud není na dně, před rozpuštěním DNA v pufru zkumavku několik minut odstřeďujte vysokou rychlostí. Případně umístěte špičku pipety do blízkosti pelety DNA a nadávkujte pufr přímo na ni; DNA se rychle rozpustí.
b. Síťovací činidlo bude navázáno na primární aminové skupiny (-NH) ligandu. Primární aminy existují na N-konci každého polypeptidového řetězce a v postranním řetězci lysinových aminokyselinových zbytků.
C. Vyhněte se použití jakýchkoli pufrů obsahujících primární aminy (např. Tris, Glycin) během procesu konjugace (prosím zkontrolujte část Compatibility Sheet).
d. Během procesu konjugace lze použít až 1 mM dithiothreitolu (DTT). Během procesu konjugace se vyvarujte použití 2-merkaptoethanolu nebo jakýchkoli jiných redukčních činidel na bázi thiolů. Pokud je nezbytné redukční činidlo, doporučuje se TCEP až do 1 mM.
E. Vyhněte se použití částečně purifikovaných proteinůamples nebo protein sampsoubory obsahující nosiče (např. BSA).
F. Pro zajištění nejvyšších reakčních výtěžků by měl být ligand rozpuštěn v pufru C. Výměna pufru se doporučuje před procesem konjugace.
G. Před zahájením krátce odstřeďte všechny zkumavky s modrým, hnědým a průhledným uzávěrem, abyste zajistili, že veškerý materiál je na dně zkumavek.
h. U molekul s molekulovou hmotností kolem nebo nižší než 5 kDa je během procesu čištění nutná zvýšená opatrnost. Malé molekuly a některé peptidy nemusí být správně purifikovány pomocí dodané chromatografické kolony. Pro více informací prosím email support@dynamic-biosensors.com.
i. Pokud je pI proteinu < 6, doporučuje se souprava pro konjugaci s nízkým pH (obj. č.: HK-NHS-3). Pro více informací prosím napište email support@dynamic-biosensors.com.
3-kroková konjugace biomolekuly k vláknu Ligandu
Před zahájením si prosím přečtěte celý protokol a proveďte všechny kroky bez přerušení.
TIP
Tento protokol může být prováděn současně pro více kopulačních reakcí.
Vyhněte se použití částečně purifikovaných proteinůamples nebo protein sampsoubory obsahující nosiče (např. BSA).
Před použitím nechejte síťovací prostředek před použitím dosáhnout pokojové teploty.
I. Nanoleverová modifikace
- Před použitím rozpusťte Ligandový řetězec NHS ve 40 µl pufru A, vortexujte, dokud se všechny pevné látky úplně nerozpustí, a krátce odstřeďte.
- Rozpusťte síťovací činidlo (hnědé víčko) přidáním 100 µl ddH2O, vortexujte, dokud se všechny pevné látky úplně nerozpustí, a krátce odstřeďte.
DŮLEŽITÉ: Vždy používejte čerstvou směs. - Přidejte 10 µl čerstvě připraveného roztoku linkeru k alikvotu jednoho vlákna Ligandu. Zbývající roztok linkeru z kroku 2 zlikvidujte.
- Vortexujte reaktanty po dobu 10 sekund, odstřeďte a inkubujte 20 minut při teplotě místnosti.
DŮLEŽITÉ Nepřekračujte dobu inkubace, jinak se sníží výtěžek reakce. - Mezitím ekvilibrujte dvě čistící kolony (červený uzávěr) pro jednu kopulační reakci:
A. Odstraňte spodní těsnění kolony a povolte uzávěr (neodstraňujte uzávěr).
b. Umístěte kolonu do 2.0 ml reakční zkumavky.
C. Odstřeďujte při 1,500 1 × g po dobu XNUMX minuty, abyste odstranili skladovací roztok.
d. Přidejte 400 µl pufru C do pryskyřičného lože kolony. Centrifugujte při 1,500 1 × g po dobu XNUMX minuty, abyste odstranili pufr.
E. Opakujte krok d a zlikvidujte výsledný pufr z reakční zkumavky. Čistící rotační kolona by nyní měla být v suchém stavu. - Sample načítání
A. Umístěte kolony z kroku 5 do nových 1.5ml reakčních zkumavek.
b. Odstraňte uzávěr odstředivého sloupce číslo 1 a použijte sample od kroku 4 k vrcholu pryskyřičného lože.
C. Centrifugujte při 1,500 2 × g po dobu XNUMX minut, abyste shromáždili sample (průtok). Po použití kolonku Purification zlikvidujte.
d. Odstraňte uzávěr odstředivého sloupce číslo 2 a použijte sample z kroku c do pryskyřičného lože.
E. Centrifugujte při 1,500 2 × g po dobu XNUMX minut, abyste shromáždili sample (průtok). Po použití kolonku Purification zlikvidujte.
II. Ligandová konjugace
- Přidejte cca. 100 µg (maximálně 200 µg) ligandu (koncentrace cca 0.5 – 50 mg/ml) do sample z kroku 6. Pro optimální podmínky použijte objem cca. 50 ul.
EXAMPLE: Upravte koncentraci proteinu na 2 mg/ml a použijte 50 µl pro konjugaci.
DŮLEŽITÉ
Ujistěte se, že skladovací pufr ligandu neobsahuje žádné primární aminy, např. Tris pufry, glycin (prosím zkontrolujte důležité poznámky). - Reakci promíchejte pipetováním nahoru a dolů a nechte reagovat při pokojové teplotě po dobu alespoň 1 hodiny.
DŮLEŽITÉ
Nevortexujte. Pokud je to nutné, může být reakce provedena při 4 °C s delší reakční dobou (např. přes noc).
III. proFIRE® Purification
- Proveďte čištění pomocí vhodného pracovního postupu proFIRE® (viz uživatelská příručka proFIRE).
Ujistěte se prosím, že sampobjem je 160 µl.
A. Pokud je objem menší než 160 µl, doplňte chybějící objem pufrem A.
b. Pokud objem překročí 160 µL, proveďte prosím dalších 160 µL, dokud seample je spotřebováno. - Použijte Data Viewpomocí softwaru proFIRE® k identifikaci, které frakce obsahují čistý konjugát.
BývalýampChromatogram je uveden v části Další informace: purifikace proFIRE® konjugátu vlákna Ligand. - Odstraňte doporučené frakce ze sběrače frakcí.
TIP
Neuchovávejte konjugát vlákna Ligand delší dobu v pufru proFIRE®. Okamžitě pokračujte ve výměně pufru.
IV. Výměna vyrovnávací paměti
- Přidejte 500 µl první frakce proFIRE® obsahující konjugát vlákna Ligand do odstředivé filtrační jednotky.
Centrifugujte při 13,000 14,000 xg (až 10 XNUMX xg) po dobu XNUMX minut a zlikvidujte průtok. - Přidejte zbývající frakce do stejné filtrační jednotky a opakujte krok centrifugace, abyste shromáždili všechny sampv jedné trubce. (Prosím zkontrolujte Další informace: Výměna a koncentrace pufru s odstředivými filtračními jednotkami).
- Přidejte 350 µl pufru PE40 (nebo TE40, HE40) a centrifugujte při 13,000 10 xg po dobu XNUMX minut. Průtok zlikvidujte.
DŮLEŽITÉ
Pokud protein není stabilní v PE40 (nebo TE40, HE40), zkontrolujte prosím kompatibilitu pufru pomocí listu kompatibility switchSENSE®. - Přidejte 350 µl pufru PE40 (nebo TE40, HE40) a centrifugujte při 13,000 15 xg po dobu XNUMX minut. Průtok zlikvidujte.
- Chcete-li získat konjugát vlákna Ligand, umístěte odstředivou filtrační jednotku dnem vzhůru do nové odstředivé sběrné zkumavky (dodané v sadě).
Otáčejte při 1,000 2 xg po dobu XNUMX minut, abyste přenesli sample k trubce.
V. Alikvoty a skladování
- Změřte absorbanci konjugátu vlákna Ligand při 260 nm (=
 ) na UV-Vis spektrofotometru (např. Nanodrop).
) na UV-Vis spektrofotometru (např. Nanodrop). - Určete koncentraci konjugátu vlákna Ligand (
 ) vložením (
) vložením (  ) do následující rovnice:
) do následující rovnice: kde d je délka dráhy (obvykle se rovná 1 cm; podívejte se však prosím do uživatelské příručky UV-Vis spektrofotometru)
kde d je délka dráhy (obvykle se rovná 1 cm; podívejte se však prosím do uživatelské příručky UV-Vis spektrofotometru) - Pro roztok připravený k použití pro funkcionalizaci biočipu upravte koncentraci na 500 nM (nebo až 1 µM) pomocí pufru PE40 (nebo TE40, HE40) (včetně až 10 % glycerolu, je-li třeba) a připravte 20 µl alikvoty .
- Skladujte při teplotě -86 °C až 8 °C podle potřeby.
Stabilita roztoku souvisí se stabilitou molekuly ligandu.
DŮLEŽITÉ
Před měřením interakce switchSENSE® přidejte do roztoku konjugátu vhodný řetězec adaptéru.
Další informace
proFIRE® purifikace konjugátu Ligandové vlákno
- Pro zajištění nejlepších výsledků z měření by na čipu neměl být přítomen žádný volný řetězec Ligandu. Proto musí být surové konjugáty ligandového řetězce před měřením purifikovány iontoměničovou chromatografií. Tento krok kontroly kvality vám poskytuje další užitečné informace o vašich sample čistota.
- Doporučujeme používat systém proFIRE® vybavený iontoměničovou kolonou, pufrem A [1] a pufrem B [5], které mají stejné složení, ale odlišnou koncentraci soli, což umožňuje separaci píku.
Na obrázku 1 je znázorněn typický proFIRE chromatogram čištění konjugátu vlákna Ligand, kde je pík konjugátu protein-DNA oddělen od volného proteinu (vlevo) a volné DNA (vpravo).
DŮLEŽITÉ: Systém proFIRE® vlastní přizpůsobený software pro automatické rozpoznávání a kvantifikaci konjugátů DNA. - Po purifikaci shromážděte frakce konjugátu vlákna Ligand (obrázek 1: frakce 8-10), zakoncentrujte konjugát a vyměňte pufr za pufr podle vašeho výběru pomocí odstředivé filtrační jednotky, jak je popsáno v části II.
 Obrázek 1. ProFIRE® chromatogram čištění konjugátu ligandového řetězce. Použité pufry: Buffer A [1] ; Pufr B [5].
Obrázek 1. ProFIRE® chromatogram čištění konjugátu ligandového řetězce. Použité pufry: Buffer A [1] ; Pufr B [5].
Kolona: DBS-chromatografická kolona. Průtok: 1 ml/min. Použitý program: délka DNA 48, typ 1.
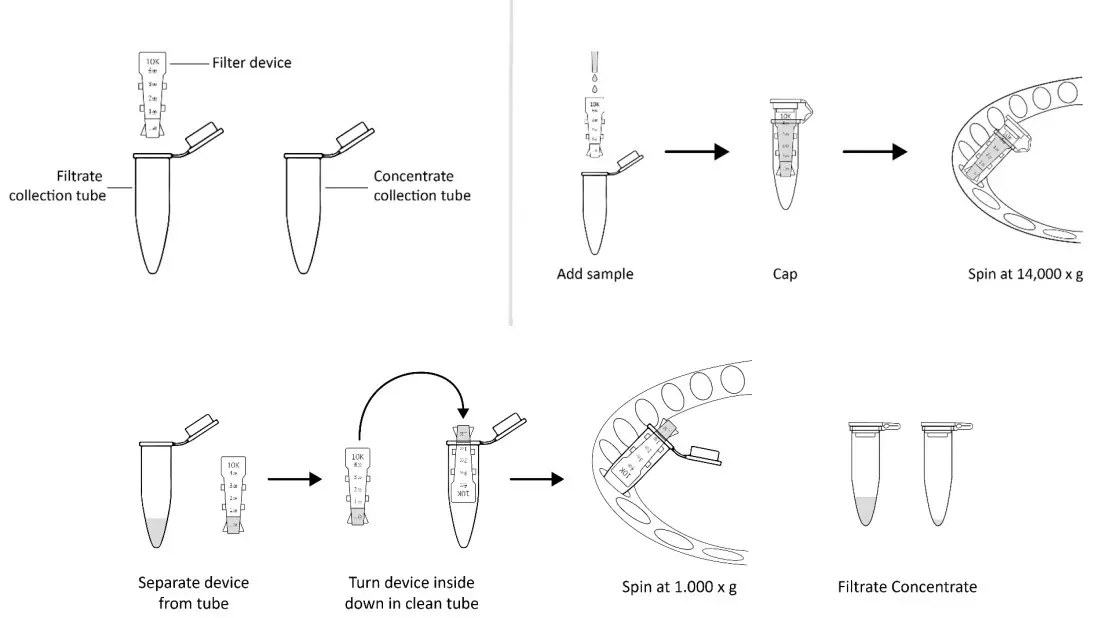
Výměna a koncentrace pufru s odstředivými filtračními jednotkami
- Vezměte jednu odstředivou filtrační jednotku, přidejte příslušný objem pufru do filtračního zařízení a uzavřete jej.
- Umístěte filtrační zařízení s uzávěrem do rotoru odstředivky a vyrovnejte pásek uzávěru směrem ke středu rotoru; protiváhu s podobným zařízením.
- Roztočte zařízení při 13,000 14,000 xg (nebo XNUMX XNUMX xg) po danou dobu.
- Odstraňte průtok a opakujte kroky 1-3.
- Vyjměte sestavené zařízení z centrifugy a oddělte filtrační zařízení od zkumavky pro mikrocentrifugu.
- Chcete-li získat konjugát, umístěte filtrační zařízení dnem vzhůru do čisté odstředivé zkumavky a vyrovnejte otevřený uzávěr směrem ke středu rotoru; protiváhu s podobným zařízením. Odstřeďováním po dobu 2 minut při 1,000 XNUMX xg se přenese sample ze zařízení do trubice.
List kompatibility
Pufrovací přísady
Konjugace ligandů se všemi dostupnými kopulačními soupravami může být provedena s mnoha různými přísadami. V následujícím seznamu jsou uvedeny všechny testované, ale mějte na paměti, že lze úspěšně použít i jiné, které zde nejsou uvedeny.
| Přísada | Až do | Vhodnost Amine Coupling | Vhodnost Thiol Coupling |
| EDTA | 1 mM | ||
| DTT* | 1 mM | ||
| TCEP | 1 mM | ||
| Tris** | 1 mM | ||
| DMSO | 2 % | ||
| ATP | 0.5 mM | ||
| MgCl2 | 2.5 mM | ||
| glycin** | — | ||
| Manitol | 8 % | ||
| Glycerol | 10 % | ||
| Trehalóza | 8 % | ||
| Histidin** | 30 mM | ||
| acetonitril*** | 50 % | ||
| Kyselina trifluoroctová | 0.1 % |
* redukční činidla na bázi thiolu
** obsahuje primární aminy
*** Pozor, může poškodit ligand
pH/pl
Hodnota pH pro konjugační pufr se může pohybovat od pH 5.0 do pH 8.0, v závislosti na charakteristikách ligandu.
Při provádění konjugace proteinů s pí < 6 mějte na paměti, že použití pufru s nižším pH může vést k lepšímu výtěžku konjugátu.
| Buffer | pH | Objednávka č | Složení |
| Fosfát-citrátový pufr | pH 5 | – | 50 mM pufrová sůl, 150 mM NaCl |
| Buffer M | pH 6.5 | BU-M-150-1 | 50 mM MES, 150 mM NaCl |
| Vyrovnávací paměť A | pH 7.2 | BU-P-150-10 | 50 mM Na2HPO4/NaH2PO4150 mM NaCl |
| Vyrovnávací paměť C | pH 8.0 | BU-C-150-1 | 50 mM Na2HPO4/NaH2PO4150 mM NaCl |
Koncentrace soli
Pro standardní konjugace se používá 50 mM pufrová sůl a 150 mM NaCl (monovalentní sůl).
Při konjugaci silně nabitých ligandů se ujistěte, že koncentrace NaCl je dostatečně vysoká (doporučuje se až 400 mM NaCl). Jinak může dojít k vysrážení DNA.
Stínící účinek monovalentních sodných kationtů vede ke stabilizaci DNA prostřednictvím neutralizace negativního náboje na cukerné fosfátové kostře.
Užitečná objednací čísla
Tabulka 3. Objednací čísla
| Název produktu | Množství | Objednávka č |
| heliX® Amine coupling kit 3 (biomolekuly s nízkým pI) | 5 konjugace | HK-NHS-3 |
| spojovací sada heliX® Thiol 1 | 5 konjugace | HK-MAL-1 |
| Odstředivá filtrační jednotka (3 kDa MWCO) | 5 ks. | CF-003-5 |
| Odstředivá filtrační jednotka (10 kDa MWCO) | 5 ks. | CF-010-5 |
| 10x Buffer A [1] | 50 ml (výtěžek 500 ml) | BU-P-150-10 |
| 5x Buffer B [5] | 50 ml (výtěžek 250 ml) | BU-P-1000-5 |
| 1x Buffer C [2] | 12 ml | BU-C-150-1 |
| 1x Buffer M [6] | 50 ml | BU-M-150-1 |
Moje poznámky
Kontakt
Dynamic Biosensors GmbH
Perchtinger Str. 8/10
81379 Mnichov
Německo
Dynamic Biosensors, Inc.
300 Trade Center, Suite 1400
Woburn, MA 01801
USA
Informace o objednávce order@dynamic-biosensors.com
Technická podpora support@dynamic-biosensors.com
www.dynamic-biosensors.com
Nástroje a čipy jsou konstruovány a vyráběny v Německu.
©2024 Dynamic Biosensors GmbH | Dynamic Biosensors, Inc. Všechna práva vyhrazena.
[1] Pufr A: 50 mM Na2HPO./NaH2PO,, 150 mM NaCl, pH 7.2
[2] Pufr C: 50 MM Na,HPO,/NaH,PO,, 150 mM NaCl, pH 8.0
[3] Pufr PE40: 10 mM Na,HPO,/NaH,PO,, 40 mM NaCl, pH 7.4, 0.05 % Tween, 50 UM EDTA, 50 uM EGTA
[4] Pro konjugaci proteinů s molekulovou hmotností vyšší než 20 kDa: Pro rychlejší koncentrační proces lze objednat odstředivé filtrační jednotky s MWCO 10 kDa (obj. č.: CF-010-5).
[5] Pufr B: 50 mM Na,HPO,/NaH,PO,, 1 M NaCl, pH 7.2
[6] Pufr M: SO mM MES, 150 mM NaCl, pH 6.5
 HK-NHS-1 v8.1
HK-NHS-1 v8.1
www.dynamic-biosensors.com
Dokumenty / zdroje
 |
dynamická sada BIOSENSORS heliX plus Amine Coupling Kit 1 [pdfUživatelská příručka HK-NHS-1, v8.1, heliX plus Amine Coupling Kit 1, heliX plus, Amine Coupling Kit 1, Coupling Kit 1, Kit 1 |